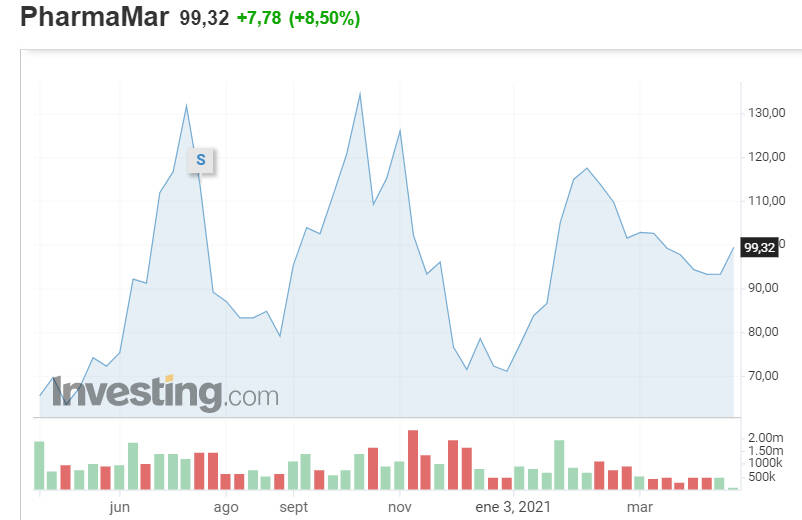
VALÈNCIA. 'PharmaMar, preparada para romper al alza'. Así lo advertía esta pasado martes Miguel Momobela, analista de XTB, ante los lectores de Valencia Plaza... y dos días después la biotecnológica gallega rompió al alza en bolsa. La cotizada presidida por José María Fernández Sousa-Faro se disparó este jueves un 8,03%, lo que la convirtió en la tercera mayor revalorización de todo el Mercado Continuo por detrás de Línea Directa, que se estrenó con un 'subidón' del 23,07%, y de Atresmedia (+8,22%).
PharmaMar (PHMR) llegó a superar durante la penúltima jornada de abril la cota psicológica de los 100 euros, que perdió el pasado 22 de abril. Lo hizo al marcar un máximo intradía de 101,35 euros, pero la lógica aparición de tomas de beneficio la llevó a despedir la sesión en los 98,70 euros -capitalizando por 1.812 millones de euros-. Suficiente para mantenerse como la más rentable en lo que va de ejercicio del Ibex 35 -y la séptima de todo el Mercado Continuo-, al revalorizarse prácticamente 40%... tras haberse catapultado un 66,50% a lo largo de 2020.
Todo ello mientras mantiene en su capital a un único bajista con nombre y apellidos como es Consonante Capital. Este 'hedge fund' o fondo de alto riesgo estadounidense vinculado al sector salud entró en PHMR el pasado 29 de marzo declarando un 0,52%; el siete de marzo ya tenía el 0,66% y un día después el 0,73%. Así lo ha constatado Valencia Plaza de la base de datos pública de la Comisión Nacional del Mercado de Valores (CNMV).
Subida con volumen
El fuerte avance de este jueves vino acompañado de una importante mejora del volumen de contratación, síntoma claro del 'apetito comprador' por las acciones de la otrora llamada Zeltia. De hecho se intercambiaron de manos 280.940 títulos frente a una media diaria anual de 149.179, según datos de Infobolsa recabados por este diario.
Pero, ¿a que se debió el 'subidón' en bolsa de PHMR este jueves? Al anuncio de la gallega de que ha recibido la autorización por parte de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) para el inicio del ensayo clínico de fase III Neptuno, que determinará la eficacia de plitidepsina para el tratamiento de pacientes hospitalizados con infección moderada de Covid-19.
Dicha autorización se ha obtenido mediante el Procedimiento Voluntario de Armonización (VHP, Voluntary Harmonisation Procedure) de ensayos clínicos de la Unión Europea, que permite la evaluación simultánea del estudio clínico por las autoridades competentes en todos los Estados Miembros participantes.
El resto de países participantes en este procedimiento (Francia, Portugal y Suecia) se irán adhiriendo a la autorización a medida que sus agencias regulatorias lo ratifiquen. Se suma así a la autorización ya recibida por la Agencia Británica del Medicamento (MHRA, Medicines and Healthcare products Regulatory Agency).
Evidencia científica de seguridad y eficacia
Tanto el diseño del protocolo de este ensayo como su autorización por parte de las autoridades reguladoras se sustenta en la evidencia científica de seguridad y eficacia obtenida en el ensayo de fase I-II APLICOV-PC con plitidepsina para el tratamiento de pacientes con Covid-19, así como todos los datos de los 1.300 pacientes ya tratados con plitidepsina en otras indicaciones.
El objetivo principal del estudio es evaluar plitidepsina frente al estándar de tratamiento autorizado y administrado en cada país (dexametasona o dexametasona en combinación con remdesivir). El objetivo primario será el porcentaje de pacientes que logran una recuperación completa en el día 8, y que no vuelven a ingresar por infección de Covid-19 después de 31 días.





















